有機化學啟迪170
1. 熱力學與動力學,是各種影響化學反應的能量因素中的重要關鍵。熱力學Thermodynamics的重點在「反應物」與「產物」的「相對能量」上,而動力學Kinetics的重點則是在解釋反應進行速率。
2. 要進行一個化學反應,「熱力學」必須有利於想要製造的產物,「反應速率」也應該要夠快,不僅是讓反應在合理的時間內完成,也要讓這個「主要反應」勝過其他「競爭反應」。
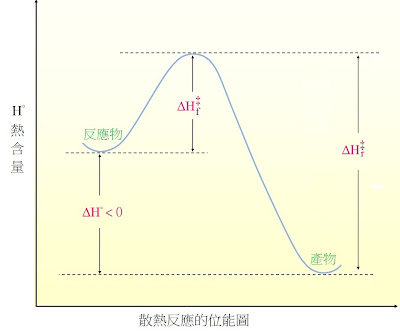
3. 我們可以用「反應剖面圖」來比較各種反應的「熱能變化」,也就是比較「反應物」與「產物」的「熱含量」。
4. 當一個反應釋放出「自由能」,這個轉換稱為「放能exergonic」,反應將會朝產生「產物」的方向進行。
5. 如果一個反應會釋放能量,而它的熵的改變小到可以忽略(許多有機反應就是如此),這個反應稱為「散熱exothermic」。
6. 能量圖形上有一些特定的數值。從「一開始的反應物質」變成「產物」的能量改變,稱為ΔH°,散熱反應ΔH°<0。
7. ΔH‡f :一個反應要進行需要突破的「活化能障壁activation energy barrier」(這是指反應物質和過度狀態之間的能量差距);ΔH‡r:逆反應的「活化能障壁」(這是指產物與過度狀態之間的能量差距)。
8. 如果一個反應的發生需要補充自由能來驅動,這個轉換稱為「吸能endergonic」。

9. 「吸熱endothermic」,這是指,產物內含的能量比反應物高的反應(熵的改變跟熱含量的改變相比,相當地小)。
10. 熱中性反應thermoneutral reaction,是指反應物與產物的能量相等的反應。
n 翻譯編寫 Marye Anne Fox, James K. Whitesell《Organic Chemistry》
徐弘毅:
1. 為什麼當一個反應是「放能exergonic」,反應將會朝產生「產物」的方向進行?
2. 所有的物質都追求能量最低、最穩定的狀態。如果化學反應會使分子的能量釋放出來,代表這個分子在化學反應後,將變成能量更低、更穩定的結構。
3. 如果一個反應會釋放能量,而它的熵的改變小到可以忽略(許多有機反應就是如此),這個反應稱為「散熱exothermic」。為什麼需要考慮熵的改變大小?
4. 如果分子打斷化學鍵釋放出來的能量,有許多轉化成增加分子系統的亂度(熵),那麼,就會吸收掉許多能量,影響到熱能。
5. 什麼是增加分子系統的亂度?舉例來說,分子變成能量較高的立體構造,甲基環己烷methylcyclohexane,如果變成軸型構象,立體張力就會變大,分子變得比較不穩定、能量較高……。
6. 為什麼進行反應需要突破「活化能障壁activation energy barrier」?
7. 化學反應,就是許多分子互相碰撞,造成化學鍵斷裂,然後原子重組成新的分子。
8. 但是分子的化學鍵並不是一撞就斷,因為化學鍵透過可以伸縮、擺動或與其他分子鍵結……等方式吸收外在撞擊的力量,繼續維持原本的結構;被打斷的化學鍵,也很容易因為沒有遇到將要鍵結的分子或原子,而恢復原本的鍵結狀態,這就是活化能障壁的由來。
9. 所以,化學反應過程,分子可能經歷無數次碰撞都沒有反應,因為力量還沒有強到可以打斷化學鍵,一直到某一次碰撞有效地打斷化學鍵,又遇上要鍵結的分子,才算突破了活化能障壁。
10. 「吸能endergonic」:為什麼有些反應的發生需要補充自由能來驅動?
11. 第一、有些分子本身非常穩定,不容易起反應,但是如果增加能量,就能使它的化學鍵鬆動,變得容易與其他化合物起反應;第二、當化學反應的產物能量比較高,補充的自由能可以轉化成鍵結的能量。
12. 「吸熱endothermic」,指產物內含的能量比反應物高的反應。比較產物的能量與反應物的能量高低,這有什麼意義?
13. 化學平衡,並不是靜止不動,而是正反應與逆反應同時進行,最後達到正逆反應速率一樣的狀態。如果是吸熱反應,產物的能量比較高,那麼,因為加熱而製造出來的許多產物,很可能會逆反應還原成反應物。這是操控反應要注意的問題。
14. 化學反應牽涉到熱力學與動力學。熱力學Thermodynamics的重點在討論「反應物」與「產物」的「相對能量」,而動力學Kinetics的重點則是在解釋反應進行速率。
15. 「熱力學」必須有利於想要製造的產物,「反應速率」也應該要夠快,不僅是讓反應在合理的時間內完成,也要讓這個「主要反應」勝過其他「競爭反應」。

沒有留言:
張貼留言