化學原理啟迪140
平衡方程式的特質
l 一個反應的方向,如果逆轉,變成逆反應,那麼它的平衡常數,就是原反應的平衡常數的倒數。
l 當一個反應的平衡方程式,乘上n倍,新反應的平衡常數,是原先反應的平衡常數的n次方。所以,Knew=(Koriginal)n。
l 平衡常數K的數值大小,取決於各種物質的濃度的次方。因此,平衡常數全看我們所研究的化學反應是什麼。
1. 質量反應定律非常實用。不論是對溶液或氣體,它都準確地描述所有化學反應系統的平衡行為。
2. 雖然對某些化學反應,例如高濃度的溶液或高壓下的氣體,我們必須修正它們非理想的行為,這還是無損於,質量反應定律精確地表達出各種化學反應的平衡的定義。
3. 舉例來說,「氨」的合成反應,在500℃的時候,這個反應的平衡常數K是6.0×10-2L2/mol2。
4. 任何時候只要N2、H2、NH3在500℃溫度下混合,這個系統一定會達到這個的平衡位置:[NH3]2/[N2][H2]3=6.0×10-2L2/mol2
5. 在500℃的時候,不論混合氣體的數量如何,合成「氨」的反應套用這個方程式,得到的數值永遠一樣。
6. 雖然在固定的溫度下,特定的化學反應,利用平衡方程式計算出來的產物與反應物比例是常數,但是,平衡濃度並不是一樣的。
7. 下表是三組合成「氨」的數據,這些數據顯示出,雖然每一組化學反應的各個物質的平衡濃度,彼此有非常大的差距,但是來自於物質彼此濃度比例的平衡常數,則維持一致(在實驗的誤差範圍內)。
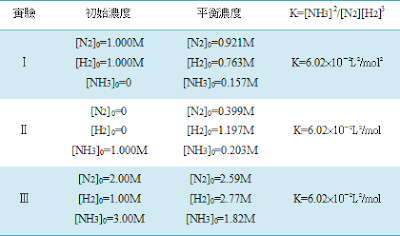 8. 特別注意,濃度括弧[ ]0的0是指反應一開始各個物質的濃度,稱為初始濃度。
8. 特別注意,濃度括弧[ ]0的0是指反應一開始各個物質的濃度,稱為初始濃度。
9. 化學反應N2(g)+3H2(g)←→2NH3(g) 的三個實驗結果:
10. 每一組合成氨的反應的「平衡濃度equilibrium concentrations」稱為「平衡位置equilibrium position」。
11. 我們必須能區分,一個化學反應的「平衡常數」與「平衡位置」,是不同的。一個在特定溫度下的特定化學系統,只有一個「平衡常數」,但是有無數個「平衡位置」。
12. 一個特定的化學反應的平衡位置,取決於這個化學反應中各物質的初始濃度,但是平衡常數則不是這樣。
n 翻譯編寫Steven S. Zumdahl《Chemical Principles》
徐弘毅:
1、理性的訓練,就是明白「因果關係」,基本有三項邏輯思考:1充足條件。2必要條件。3充要條件。這是國民義務教育中,很重要的訓練內容。
2、充足條件,A=C,B=C,A不同於B。例如,3+6=9,要得到9,一定要3+6?2+7也可以,4+5也可以。
3、又例如,在500℃,合成氨的反應要達到平衡,各物質的濃度可以是[N2]=0.921M、[H2]=0.763M、[NH3]=0.157M,也可以是[N2]=0.399M、[H2]=1.197M、[NH3]=0.203M……等等各種平衡位置。達到反應平衡的平衡位置有許多種,平衡位置是充要條件。
4、必要條件,例如:「努力」不一定會成功,但是不努力一定不會成功;「努力」只是成功的條件之一。
5、質量反應定律,不一定能完全預測所有的化學反應,濃度的溶液或高壓下的氣體,我們必須修正它們非理想的行為;但是沒有質量反應定律,就一定沒有辦法預測化學反應。質量反應定律是預測化學反應的條件之一。
6、充要條件,例如:二氧化碳,其中必定有碳元素,沒有「碳元素」就不是二氧化碳。
7、一個在特定溫度下的特定化學系統,只有一個「平衡常數」。所以,達到平衡的反應,各物質濃度依據平衡公式計算的結果,一定符合平衡常數;如果物質濃度計算結果,不符合平衡常數,就沒有達成平衡。
8、真理的追求,是教育工作要訓練每一個人養成的「習慣」,包括:1要合乎事實,提出完整的證據。2要合乎邏輯思考,不違反推論法則。
9、提供良好的教材,教育就成功了一大半。好老師,必定自編教材或課本。一綱一本,是獨裁者的做法,泯滅教育精神。
10、好教材(課本)的原則:1達成教育「認知、情意、技能」三種目標。2適合學生心理程度。3內容生動有趣。4訓練好邏輯思考。
沒有留言:
張貼留言